Alternativmethoden für die medizinische und toxikologische Forschung
Forschungsstrategien der Pharmaindustrie auf dem Prüfstand
Jedes Jahr investiert die Pharmaindustrie Milliarden von Euro 1) und setzt Millionen von Versuchstieren ein, um neue Medikamente zu entwickeln. Doch nahezu 70 Prozent der getesteten Moleküle fallen bei den klinischen Tests durch, weil sie entweder nicht wirksam oder toxisch sind 2). Zahlreiche Analysen, die in führenden Wissenschaftsmagazinen wie Nature oder Science publiziert wurden, machen die mangelnde Relevanz von Tiermodellen als möglichen Grund für diese Misserfolge aus und schlagen einen strategische Neuorientierung der Forschung vor: vom Tiermodell hin zu Alternativmethoden, die auf menschlichen Zellen basieren und repräsentativer und somit aussagekräftiger für die menschliche Biologie sind 3).

Krebsforschung: Wir brauchen bessere Modelle
In besonderem Masse trifft diese Feststellung auf die Onkologie zu. Hier können die wenigen Moleküle, die von den Arzneimittelbehörden tatsächlich zugelassen werden 4), das Leben der Patienten in den meisten Fällen höchstens um ein paar Monate verlängern, die Krankheit aber nicht heilen.
Der Tumor: eine komplexe Struktur
Man weiss heute, dass Tumoren eine heterogene Struktur haben, die aus der ständigen Interaktion zwischen unterschiedlichen Krebszellentypen und ihrem unmittelbaren Umfeld entsteht. Die Bildung und das Wachstum von Tumoren hängen also sowohl von den mechanischen Bedingungen des umliegenden normalen Gewebes ab als auch von molekularen Signalen aus den gesunden Zellen dieses Gewebes. Zum Beispiel können Tumorzellen die Eigenschaften von Zellen der umliegenden Matrix, etwa Fibroblasten oder Endothelzellen, beeinflussen, um das Tumorwachstum zu begünstigen. Mehrere Studien haben gezeigt, dass die Fähigkeit eines Medikaments, zum Tumor zu gelangen, und seine Wirksamkeit bei der Zerstörung der Krebszellen von den Eigenschaften der jeweiligen Mikroumgebung eines Tumors abhängen 5). Deshalb müssen Modelle zur Entwicklung von neuen Krebstherapien unbedingt auf einem in seiner Mikroumgebung integrierten Tumor beruhen.
Ungeeignete Tiermodelle

Die meisten präklinischen Modelle sind Tiermodelle, obwohl diese für die Physiologie von menschlichen Tumoren nicht repräsentativ genug sind. Im aktuell verwendeten Tiermodell mit Xenotransplantation, bei dem menschliche Tumorzellen oder -fragmente unter die Haut einer Maus implantiert werden, ist das ursprüngliche menschliche Mikroumfeld nicht mehr vorhanden. Dies führt zu einer Deregulierung und einem zu schnellen Tumorwachstum, das nicht der beim Patienten beobachteten In-vivo-Situation entspricht. Das beschleunigte Wachstum und die inadäquate Umgebung machen diese künstlichen Tumore sehr anfällig auf antitumoröse Substanzen. Dies führt dazu, dass viele Moleküle ausgewählt werden, die sich in klinischen Tests beim Menschen als unwirksam erweisen. Zahlreiche Publikationen haben bestätigt, dass die molekularen Mechanismen, die für die Tumorbiologie eine Rolle spielen, sich bei Mensch und Maus in grundlegenden Punkten unterscheiden. Dazu gehören etwa die Transkriptionsregulation, die Telomerase-Aktivität, Transformationsmechanismen, die Zytokinproduktion sowie die Zusammensetzung der extrazellulären Matrix 6). Trotzdem werden in der Krebsforschung immer noch millionenfach Maus- und Rattenmodelle verwendet, und jedes positive Ergebnis wird gross als Hoffnungsträger für die Entwicklung neuer Krebstherapien angekündigt.
In-vitro-Modelle werden immer zuverlässiger
Die aktuellen Fortschritte im Bereich der Zellkulturen und der Züchtung von menschlichem Gewebe (Tissue-Engineering) ermöglichen heute die Entwicklung von alternativen In-vitro-Modellen für die Krebsforschung, mit denen sich die Tumorerkrankung näher an den beim Patienten herrschenden Bedingungen reproduzieren lässt. Unter anderem kommen bereits heute die folgenden Forschungsmodelle zum Einsatz:
Modell mit multizellulären Tumorsphäroiden (MCTS)
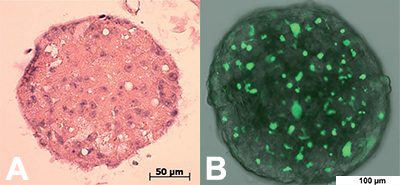
Für dieses dreidimensionale Modell werden Tumorzellen in vitro als kugelförmige Aggregate (Sphäroide) kultiviert (Abb. 1), um die Interaktion zwischen den Zellen zu erhöhen. Wenn die Sphäroide eine gewisse Grösse erreicht haben, verfügen sie über eine Randzone mit proliferierenden (sich schnell teilenden und wachsenden) Zellen, einen mittleren Teil mit ruhenden Zellen und einen Kern mit nekrotischen (abgestorbenen und sterbenden) Zellen. Diese Struktur imitiert die verschiedenen Abstufungen der Sauerstoff- und Nährstoffversorgung von menschlichen Tumoren. Die Sphäroide können zudem auch zusammen mit Zellen der extrazellulären Matrix, der Mikrovaskulatur oder sogar des Immunsystems kultiviert werden, so dass die Mikroumgebung des Tumors simuliert wird.
Seit es gelungen ist, die Herstellung von Sphäroiden zu automatisieren, wird dieses Modell von der Pharmaindustrie sehr häufig eingesetzt. Es ermöglicht das Testen sehr vieler Moleküle (Hochdurchsatz-Screening) an Mikrokarzinomen des Dickdarms, der Prostata, der Leber, der Niere und des oberen Aerodigestivtrakts (Mund- und Rachenraum). So können die vielversprechendsten Arzneistoffe rasch selektiert und dann an komplexeren Modellen getestet werden. Dieses Modell wurde beispielsweise bei der Entwicklung von Catumaxomab eingesetzt, einem Antikörper, der heute von der Europäischen Arzneimittel-Agentur (EMA) für die Therapie von maligner Aszites (Bauchwassersucht infolge von Krebs) zugelassen ist.
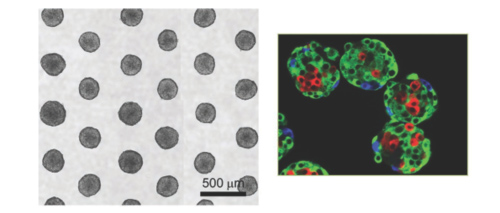
Abb. 1: Bespiele von Mikrosphären (links) und Markierung der verschiedenen Zelltypen (rechts), Labarbera 2012.
Modell mit rekonstruiertem kanzerösem Gewebe
Dank Tissue-Engineering und Bioprinting lassen sich verschiedenste Zelltypen selektionieren und reorganisieren, um daraus in vitro ein menschliches Gewebefragment zu rekonstruieren. Sind in diesem Gewebe Tumorzellen enthalten, wird es möglich, den Wachstumsprozess von Mikrotumoren in einer funktionellen Umgebung nachzubilden und dadurch den Krankheitsverlauf beim Patienten zu simulieren. Solch komplexe Modelle gibt es bereits für Melanome sowie für Lungenkrebs (OncoCilAir™). Sie sind besonders interessant, weil sich daran nicht nur die Wirksamkeit eines möglichen Arzneimittels auf die Tumorzellen testen lässt, sondern auch dessen Toxizität für die gesunden Zellen der Kultur.
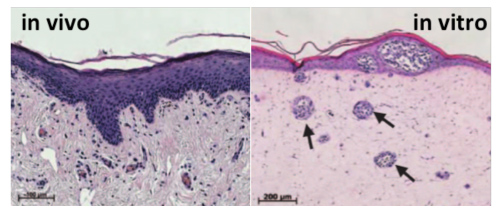
Abb. 2: Querschnitt durch natürliche menschliche Haut (links) und In-vitro-Hautmodell mit Melanomen (rechts, Pfeile).
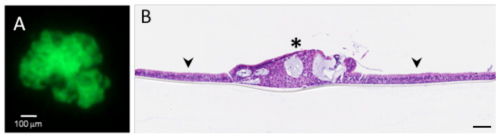
Abb. 3: (A) Tumorknoten und (B) Querschnitt durch In-vitro-Lungengewebe (Pfeil) mit Tumor (Stern).
Das Modell OncoCilAir™ hat den Vorteil, dass es mehrere Monate funktionsfähig bleibt, so dass damit kurz- und langfristige Therapien getestet und gleichzeitig die Dosen simuliert werden können, die den Patienten in den klinischen Studien verabreicht werden sollen.
In-vitro-Modelle für die personalisierte Medizin
Heute weiss man, dass ein und derselbe Krebstyp durch unterschiedliche Mutationen entstehen kann. Das erklärt, warum zum Beispiel nicht alle Patienten mit Darmkrebs auf die gleiche Therapie ansprechen. Ideal wäre es, wenn man die Wirksamkeit aller verfügbaren Therapien auf jeden einzelnen Tumor testen könnte, um so für jeden Patienten die passende Therapie herauszufiltern. In diesem Fall spricht man von personalisierter Medizin. Diese Strategie, die für Darmkrebs (Kolonkarzinom) bereits weit fortgeschritten ist, wird vermutlich bald klinisch eingesetzt werden. Sie ermöglicht auch die Untersuchung der Expression von Biomarkern an direkt vom Patienten stammendem menschlichem Zellmaterial in verschiedenen Behandlungsphasen, um die Entwicklung der Krankheit zu prognostizieren.
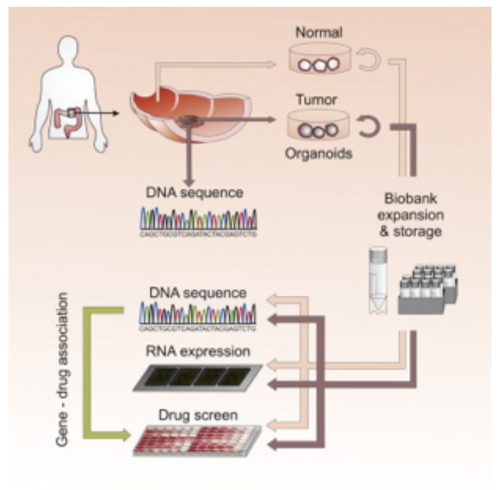
Abb. 4: Personalisierte Medizin dank eines In-vitro-Kolonkarzinom-Modells.
Erkrankungen von Atemwegen und Lunge
Das In-vitro-Modell MucilAir™
Mit der zunehmenden Luftverschmutzung haben sich Erkrankungen des Atemtrakts wie Allergien, Asthma oder die Chronisch obstruktive Lungenerkrankung (COPD) zu schwerwiegenden Gesundheitsproblemen entwickelt. Dank Tissue-Engineering können aus Operationsabfällen In-vitro-Modelle der verschiedenen Erkrankungen rekonstruiert werden. Ein solches In-vitro-Modell ist das Atemwegsepithel MucilAir™, das von den Forschern der Genfer Firma Epithelix entwickelt wurde. Dieses rekonstruierte Atemwegsgewebe kann Tierversuche bei Toxizitätstests (Wirkung von Luftschadstoffen, chemischen Substanzen, inhalierten Stoffen usw.) und bei der Entwicklung von neuen Medikamenten ersetzen.
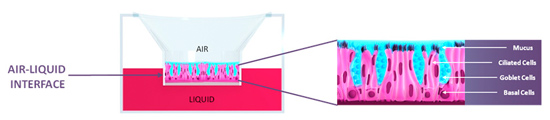
In-vitro-Modelle ohne gleichwertiges Tiermodell
Cystische Fibrose
Gewisse menschliche Erbkrankheiten lassen sich am Tiermodell nur schwer darstellen. Hier machen In-vitro-Modelle des Atemwegsgewebes eine weiterführende Forschung erst möglich. Das ist zum Beispiel bei der Cystischen Fibrose (auch Mukoviszidose genannt) der Fall. Bei dieser Krankheit führt eine Fehlfunktion des Chloridkanals CFTR dazu, dass Drüsensekrete zähflüssig werden und sich zum Beispiel in den Atemwegen ansammeln, was zu zahlreichen Infektionen unter anderem mit resistenten Keimen führen kann. Von den vielen Maus- und Rattenmodellen, die für diese Krankheit entwickelt wurden, konnte keines die charakteristischen Veränderungen des Lungengewebes reproduzieren, die bei Patienten beobachtet wurden. Das Modell MucilAir™, das aus Zellen mit Mutationen im CFTR-Gen gezüchtet wird, ermöglicht die Reproduktion des respiratorischen Phänotyps der Cystischen Fibrose für die Entwicklung und Überprüfung von neuen Medikamenten.
Virusinfektionen
MucilAir™ wird auch erfolgreich im Bereich der Viruserkrankungen eingesetzt. Gewisse Virenstämme haben einen Wirtstropismus, das heisst, sie können beispielsweise ausschliesslich in menschlichen Atemwegssekreten gedeihen. Ohne Replikationsmodelle gibt es folglich keine Möglichkeit, diese Viren im Labor zu erforschen. Das ist etwa beim Rhinovirus C (HRV-C) der Fall, das beim Menschen für Schnupfen verantwortlich ist. Kürzlich ist mit dem MucilAir™-Modell die erste In-vitro-Replikation der HRV-C-Stämme 2, 7, 12, 15 und 29 gelungen. Dasselbe Modell ermöglicht auch die In-vitro-Replikation von Grippeviren und der für Hepatitis verantwortlichen Bocaviren.
Dreidimensionale In-vitro-Modelle – mehr Medikamentensicherheit für Patienten
Lebertoxizität
Eines der Hauptprobleme bei der Arzneimittelentwicklung ist die Lebertoxizität. Bevor ein Molekül in klinischen Studien getestet werden kann, muss zwingend dessen toxikologisches Profil (ADME) ermittelt werden. Tiermodelle oder klassische zweidimensionale Zellkulturen können die Komplexität eines dreidimensionalen Organs nicht wiedergeben. Deshalb können die an diesen Modellen erzielten Testergebnisse die Toxizität in der In-vivo-Situation beim Menschen nur teilweise vorhersagen. Aktuelle Daten zeigen, dass das HepaRG-Modell, das aus organotypischen 3D-Kulturen von menschlichen Leberzellen besteht, besser geeignet ist als Tiermodelle, weil es deutlich aussagekräftigere und zuverlässigere Informationen liefert.
Die Zukunft der Forschung und der Medizin
Wie werden sich die neuen tierversuchsfreien Forschungsmethoden in Zukunft entwickeln? Alles hängt von den Mitteln ab, die für diese vielversprechenden Methoden zur Verfügung gestellt werden. Bereits heute ist jedoch die Entwicklung vieler interessanter Methoden weit fortgeschritten und verspricht aufsehenerregende Fortschritte für die Forschung und die menschliche Gesundheit.
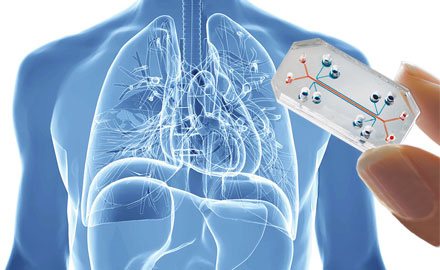
Das Multi-Organ-Chip-Modell
Dieser Modelltyp ist aus der Arbeit von Prof. Donald Ingber vom Wyss Institute der Harvard University (USA) hervorgegangen. Er war der erste, der ein Mikrofluidsystem herstellte, indem er mehrere in Mikroinkubationskammern platzierte Zelltypen miteinander verband. Diese miteinander verbundenen Mikro-Organe ermöglichen die Simulation von zusammenhängenden physiologischen Reaktionen. Die systemische Absorption von Arzneimitteln, die Metabolisierung eines Wirkstoffs in Dünndarm und Leber sowie dessen Ausscheidung über die Nieren sind entscheidend für die Wirksamkeit und Sicherheit dieses Stoffes in der therapeutischen Anwendung. Doch in den meisten In-vitro-Tests fehlen diese systemischen Rückmeldungen. Dank Mikrofluidik und Tissue-Engineering kann man heute die Physiologie dieser Organe simulieren, und die Mikro-Organe (Haut, Darm, Leber und Niere) bleiben einen ganzen Monat lang funktionsfähig. Dieses System macht es möglich, toxikologische Profile (ADME) von potenziellen Wirkstoffen in vitro zu erstellen und somit auf Tierversuche zu verzichten. Das nächste Ziel ist nun, noch umfassendere Organ-Chips zu entwickeln, auf denen die meisten menschlichen Organe simuliert werden.
Ganze Organe aus dem 3D-Drucker
Dreidimensionales Bioprinting ist eine Form des 3D-Drucks, bei der Zellen Schicht um Schicht auf Biomatrices gedruckt werden, um die Struktur eines ganzen Organs zu konstruieren. Mittels Bioprinting konnten bereits Haut, Knochen, Gefässprothesen, Luftröhrenschienen, Herzgewebe und Knorpelstrukturen produziert werden. Diese noch sehr junge Methode ist vielversprechend, nicht nur für die Regenerative Medizin, sondern auch für die Entwicklung von Medikamenten und für toxikologische Studien.

Die Immunologie – eine Herausforderung für die Entwicklung von Alternativmethoden
Gemäss dem aktuellen Bericht der Europäischen Kommission 7) werden über 60 Prozent der Versuchstiere im Bereich Humanmedizin eingesetzt. Die zwei wichtigsten Forschungsbereiche sind die Immunologie (15 % der Tiere) und die Krebsforschung (13 %), (UK 2013 Report, Home Office).
Während in der Krebsforschung zahlreiche innovative Alternativmethoden entwickelt werden, gibt es bis heute kein alternatives In-vitro-Modell, mit dem sich die Physiologie des Immunsystems vollständig reproduzieren lässt. Und der Weg bis zu einer solchen Lösung scheint noch lang.
In absehbarer Zukunft werden wohl eher in silico, mithilfe von mathematischen Modellen Algorithmen entwickelt, welche die Immunreaktionen simulieren. Mehrere Forschungsgruppen beschäftigen sich bereits mit diesem Ansatz 8).
Keine Verschwendung von menschlichem Gewebe
Ein Grossteil der Alternativmethoden für die Grundlagenforschung beruht auf der direkten Nutzung von menschlichem Gewebe aus Operations- oder Biopsie-Abfällen. Diese Gewebeabfälle sind eine wertvolle Ressource. Wissenschaftliche Labors oder Biotechnologiefirmen müssen vermehrt Zugriff darauf erhalten.
Dafür braucht es eine bessere Verwertung der menschlichen Gewebeabfälle, eine bessere Organisation der Sammelstellen, aber auch eine Lockerung der zu strengen gesetzlichen Bestimmungen, ohne jedoch dabei ethische Grundsätze und die Würde des Menschen zu verletzen.
Heute müssen Spitäler fast alle menschlichen Gewebeabfälle für viel Geld im Krematorium verbrennen, während gleichzeitig zahlreiche Forschungsgruppen das für ihre Arbeit nötige Gewebe nur mit Mühe auftreiben können.
Eine Alternative zur «Rezyklierung» dieses menschlichen Gewebes könnte sich aus verbesserten Methoden für die Zell-Reprogrammierung ergeben. Dabei können Stammzellen zu einem beliebigen (spezialisierteren) Körperzellentyp differenziert sowie umgekehrt differenzierte Zellen zu (weniger spezialisierten) Vorläuferzellen dedifferenziert werden. Daraus ergibt sich eine unerschöpfliche Quelle für patientenspezifische Zellen.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Anmerkungen:
1) Die Pharmaunternehmen setzen etwa 10 bis 20 Prozent ihres Umsatzes für die Erforschung und Entwicklung von neuen Produkten ein.
2) Arrowsmith 2012, 2013.
3) Scannell 2012.
4) Weniger als fünf Prozent, Hutchinson 2011, Bhattacharjee 2012.
5) Song, 2014, Straussman 2012, Lee 2014.
6) Forsyth 2002, Odom 2007, Ramgarajan 2004, Mestas 2004, Seok 2013, Dorman 2010.
7) Bericht EU COM (2013) 859.
8) Vergleiche hierzu die Arbeiten in computergestützter Biologie der Forschungsgruppe von Prof. Regoes (Garcia 2015).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Literatur:
Amann A et al. Development of an innovative 3D cell culture system to study tumour–stroma interactions in non-small cell lung cancer cells. PLoS One. 2014 (doi:10.1371/journal.pone.0092511).
Bhattacharjee Y. Biomedicine. Pharma firms push for sharing of cancer trial data. Science. 2012 (doi: 10.1126/science.338.6103.29.)
Deng, X., Li, Y., & Qiu, J. Human bocavirus 1 infects commercially available primary human airway epithelium cultures productively. 2014 Journal of virological methods, 195, 112-119.
Fernández-Sánchez ME et al. Mechanical induction of the tumorigenic β-catenin pathway by tumour growth pressure. Nature. 2015 (doi: 10.1038/nature14329).
Garcia V, Richter K, Graw F, Oxenius A, Regoes RR: Estimating the in vivo killing efficacy of cytotoxic T lymphocytes across different peptide-MHC complex densities. PLoS Computational Biology 2015, 11(5):e1004178.
Ghosh S et al. Use of multicellular tumor spheroids to dissect endothelial cell-tumor cell interactions: a role for T-cadherin in tumor angiogenesis. FEBS Lett. 2007 581(23):4523-8.
Grubb BR, Boucher RC. Pathophysiology of gene-targeted mouse models for cystic fibrosis. Physiol Rev. 1999 79(1 Suppl):S193-214.
Hoffmann TK et al. A novel mechanism for anti-EGFR antibody action involves chemokine-mediated leukocyte infiltration. Int J Cancer. 2009 (doi: 10.1002/ijc.24269).
Hutchinson L . High drug attrition rates—where are we going wrong? Nature Reviews Clinical Oncology. 2011 (doi:10.1038/nrclinonc.2011.34).
Huh, D., et al., Reconstituting organ-level lung functions on a chip. Science, 2010. 328(5986):p. 1662-8.
Hirschhaeuser F, Leidig T, Rodday B, Lindemann C, Mueller-Klieser W. Test system for trifunctional antibodies in 3D MCTS culture. J Biomol Screen. 2009 (doi: 10.1177/1087057109341766).
Hirschhaeuser F, Menne H, Dittfeld C, West J, Mueller-Klieser W, Kunz-Schughart LA. Multicellular tumor spheroids: an underestimated tool is catching up again. J Biotechnol. 2010 (doi:10.1016/j.jbiotec.2010.01.012).
Juozapaitis et al. An infectious bat-derived chimeric influenza virus harbouring the entry machinery of an influenza A virus. 2014 Nature communications,5.
Konur A, Kreutz M, Knüchel R, Krause SW, Andreesen R. Cytokine repertoire during maturation of monocytes to macrophages within spheroids of malignant and non-malignant urothelial cell lines. Int J Cancer. 1998 78(5):648-53.
Labarbera DV, Reid BG, Yoo BH. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opin Drug Discov. 2012 (doi: 10.1517/17460441.2012.708334)
Lee JJ et al. Stromal response to Hedgehog signaling restrains pancreatic cancer progression. Proc Natl Acad Sci U S A. 2014 (doi: 10.1073/pnas.1411679111).
McMillin DW, Negri JM, Mitsiades CS. The role of tumour-stromal interactions in modifying drug response: challenges and opportunities. Nat Rev Drug Discov. 2013 (doi: 10.1038/nrd3870).
Mueller D, Krämer L, Hoffmann E, Klein S, Noor F. 3D Organotypic HepaRG cultures as in vitro model for acute and repeated dose toxicity studies. Toxicol In Vitro. 2014 (doi: 10.1016/j.tiv.2013.06.024)
Mas C, Boda B, CaulFuty M, Huang S, Wiszniewski L and Constant S. Antitumour efficacy of the selumetinib and trametinib MEK inhibitors in a combined human airway-tumour-stroma lung cancer model. 2015 J Biotechnol (doi:10.1016/j.jbiotec.2015.01.012)
Maschmeyer et al. A four-organ-chip for interconnected long-term co-culture of human intestine, liver, skin and kidney equivalents. 2015 Lab Chip, (DOI: 10.1039/C5LC00392J)
Murphy SV and Atala A. 3D bioprinting of tissues and organs. 2014 Nat Biotechnol. (doi: 10.1038/nbt.2958).
Ocana A, Pandiella A, Siu LL, Tannock IF. Preclinical development of molecular-targeted agents for cancer. Nat Rev Clin Oncol. 2010 (doi: 10.1038/nrclinonc.2010.194).
Rodríguez-Enríquez S, et al. Energy metabolism transition in multi-cellular human tumor spheroids. J Cell Physiol. 2008 (doi: 10.1002/jcp.21392).
Roth A, Singer T. The application of 3D cell models to support drug safety assessment: opportunities & challenges. 2014. Adv Drug Deliv Rev. (doi: 10.1016/j.addr.2013.12.005).
Saint-Criq et al. Restoration of chloride efflux by azithromycin in airway epithelial cells of cystic fibrosis patients. Antimicrob Agents Chemother. 2011 ( doi: 10.1128/AAC.01403-10).
Sequist et al. Implementing multiplexed genotyping of non-small-cell lung cancers into routine clinical practice. 2011 Ann. Oncol. 22, 2616–2624.
Straussman R et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 2012 (doi: 10.1038/nature11183).
Song G et al. Effects of tumor microenvironment heterogeneity on nanoparticle disposition and efficacy in breast cancer tumor models. Clin Cancer Res. 2014 (doi: 10.1158/1078-0432.CCR-14-0493)
Scannell JW, Blanckley A, Boldon H, Warrington B. Diagnosing the decline in pharmaceutical R&D efficiency. Nat Rev Drug Discov. 2012 (doi: 10.1038/nrd3681).
Tapparel, C., Sobo, K., Constant, S., Huang, S., Van Belle, S., & Kaiser, L. Growth and characterization of different human rhinovirus C types in three-dimensional human airway epithelia reconstituted in vitro. 2013 Virology, 446(1), 1-8.
Thoma CR. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Adv Drug Deliv Rev. 2014 (doi: 10.1016/j.addr.2014.03.001).
Van de Wetering et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015 (doi: 10.1016/j.cell.2015.03.053).
Vörsmann H et al. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death Dis. 2013 ( doi:10.1038/cddis.2013.249).
Walles et al., The potential of bioartificial tissues in oncology research and treatment. Onkologie, 2007. 30(7): p. 388-94.


