I metodi sostitutivi per la ricerca medica e tossicologica
Rimesse in questione le strategie di ricerca dell’industria farmaceutica
Ogni anno, le industrie farmaceutiche investono miliardi di euro (1) ed utilizzano milioni di animali con lo scopo di sviluppare nuovi farmaci. Eppure praticamente il 70% delle molecole testate in sperimentazione clinica saranno dequalificate, per inefficacia o per tossicità (2). Oggi, numerose analisi pubblicate in importanti riviste scientifiche come Nature o Science, citano la mancanza di pertinenza dei modelli animali come possibile motivo di questo insuccesso, e suggeriscono di modificare le strategie di ricerca utilizzando un maggior numero di modelli sostitutivi basati su cellule umane, alfine di essere più rappresentativi della biologia umana e dunque più predittivi (3).

Ricerca sul cancro : abbiamo bisogno di modelli di studio migliori !
Questa constatazione è particolarmente pertinente nel settore dell’oncologia, in cui le rare molecole convalidate dalle autorità del farmaco (4), nella maggior parte dei casi riescono soltanto a prolungare la vita del paziente di qualche mese, senza per questo sradicare la malattia.
Il tumore : una struttura complessa
Sappiamo oggi che un tumore è una struttura eterogenea risultante dall’interazione permanente tra diversi tipi di cellule cancerose ed il loro ambiente immediatamente circostante. Dunque la formazione e la crescita di un tumore rispondono al tempo stesso a sollecitazioni meccaniche provenienti dai tessuti normali adiacenti ed a segnali molecolari provenienti dalle cellule sane che compongono questi tessuti. Le cellule tumorali hanno per esempio la capacità di sviare le proprietà di cellule presenti nella matrice circostante, quali i fibroblasti o le cellule endoteliali, per favorire la propria crescita. Diversi studi hanno dimostrato che la capacità di un farmaco di colpire il tumore, come pure la sua capacità di eliminare le cellule cancerose, dipendono dalla natura stessa del microambiente di questo tumore (5). Per tutti questi motivi, è fondamentale inserire il tumore ed il suo microambiente nei modelli che consentono lo sviluppo di nuove terapie.
Modelli animali imperfetti

La maggior parte dei modelli preclinici sono modelli animali, anche se non sono abbastanza rappresentativi della fisiologia dei tumori umani. Dunque, nel modello animale correntemente utilizzato dello « xenotrapianto » in cui cellule o frammenti di tumori umani sono impiantati sotto la pelle del topo, l’ambiente umano originale del tumore va perso, generando un difetto di regolazione ed una crescita troppo rapida del tumore che non corrisponde alla situazione osservata in vivo nel paziente. Per via della loro crescita rapida e di un ambiente inadeguato, questi tumori artificiali diventano molto sensibili agli anticancro e conducono a selezionare molecole che si riveleranno inefficaci nei test clinici effettuati sull’uomo. Numerose pubblicazoini hanno confermato l’esistenza di differenze fondamentali tra il topo e l’uomo nei meccanismi molecolari coinvolti nella biologia dei tumori quali la regolazione della trascrizione, l’attività delle telomerasi, i meccanismi di trasformazione, la produzione di citochine o la composizione della matrice extracellulare (6). Malgrado tutto i modelli murini continuano ad essere utilizzati a milioni per la ricerca contro il cancro, ed ogni risultato positivo è annunciato come molto promettente per lo sviluppo di nuove terapie.
Modelli in vitro sempre più predittivi
I recenti progressi in materia di coltura cellulare ed ingegneria tissutale umana consentono oggi di sviluppare in vitro dei modelli di cancro sostitutivi che riproducono in modo sempre più fedele la malattia quale si sviluppa nei pazienti. Tra i modelli già utilizzati per la ricerca, si possono citare in particolare :
Il modello «multicellular tumor spheroids» (MCTS)
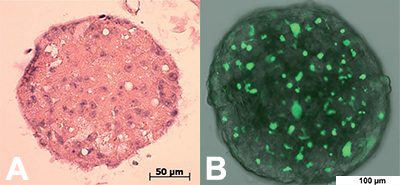
In questo modello, vengono coltivate cellule cancerose in vitro in 3D per intensificare le interazioni tra le cellule, sotto forma di piccoli organoidi sferici (ill. 1). Quando gli sferoidi raggiungono una determinata dimensione, presentano una zona esterna in proliferazione, una zona intermedia quiescente ed un nucleo centrale necrotico, un’organizzazione che consente di riprodurre i gradienti di nutrimenti e di ossigenazione quali esistono nel tumore umano originale. Peraltro questi sferoidi possono essere coltivati in presenza di cellule della matrice extracellulare, della microvasculatura o addirittura del sistema immunitario che contribuiscono a simulare il microambiente del tumore.
Da quando è possibile automatizzare la fabbricazione degli sferoidi, questo modello è molto diffuso nell’industria farmaceutica. Consente di testare un gran numero di molecole (High Throughput Screening) su micro-cancri del colon, della prostata, del fegato, del rene e delle vie aerodigestive superiori nonchè di selezionare rapidamente i candidati farmaci più promettenti che saranno poi testati su modelli più complessi. Questo modello è stato utilizzato per esempio per la messa a punto del Catumaxomab, un anticorpo oggi convalidato dall’EMA (Agenzia Europea Medicinali) per il trattamento di asciti maligne.
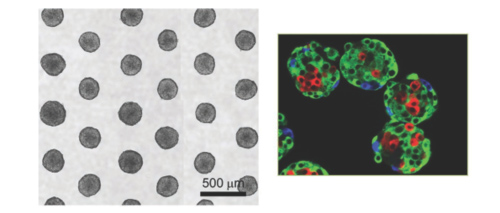
ill. 1 : esempio di microsfere (sinistra) e marcatura dei diversi tipi cellulari (destra), Labarbera 2012
Il modello dei « tessuti cancerosi ricostituiti »
Grazie ai metodi di ingegneria tissutale e di bio-printing è possibile selezionare e riorganizzare molteplici tipi cellulari per ricostruire in vitro un frammento di tessuto umano. Incorporando cellule tumorali in questi tessuti, diventa possibile ricostituire il processo di crescita di microtumori in un ambiente funzionale e pertanto simulare la malattia quale si sviluppa nel paziente. Questi modelli complessi esistono per il cancro del melanoma ed il cancro al polmone (OncoCilAir™). Presentano un grande interesse poichè consentono di testare non solo l’efficacia del futuro farmaco sulla parte tumorale, ma anche la sua possibile tossicità sulle cellule sane della coltura.
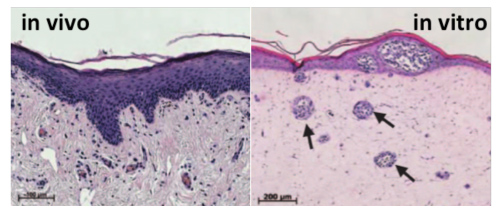
ill. 2 : sezione di pelle umana nativa (a sinistra) e ricostituita in vitro con melanomi (a sinistra, frecce)
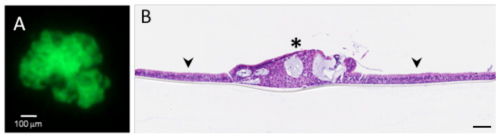
ill 3 : (A) nodulo tumorale e (B) sezione di tessuto polmonare (freccia) con tumore (stella) ricostituito in vitro
Il modello OncoCilAir™ presenta il vantaggio di rimanere funzionale per diversi mesi, ciò che consente di testare al tempo stesso trattamenti acuti e cronici e dunque simulare dosaggi che saranno prescritti ai pazienti durante le sperimentazioni cliniche.
Modelli in vitro per la medicina personalizzata
E’ ormai appurato che un cancro dello stesso tipo può risultare da mutazioni diverse, ciò che spiega che non tutti i pazienti che soffrono per esempio di un cancro al colon sono necessariamente sensibili allo stesso trattamento. L’ideale sarebbe poter testare l’efficacia di tutti i trattamenti disponibili su ogni tumore alfine di individuare una terapia idonea su misura per ogni paziente: si tratta della medicina personalizzata. Indubbiamente questa strategia, già performante per il cancro al colon sarà rapidamente utilizzata in clinica. Consente anche di studiare l’espressione di biomarcatori direttamente su materiale umano proveniente dal paziente in diversi momenti del trattamento, in modo da predire l’evoluzione della malattia.
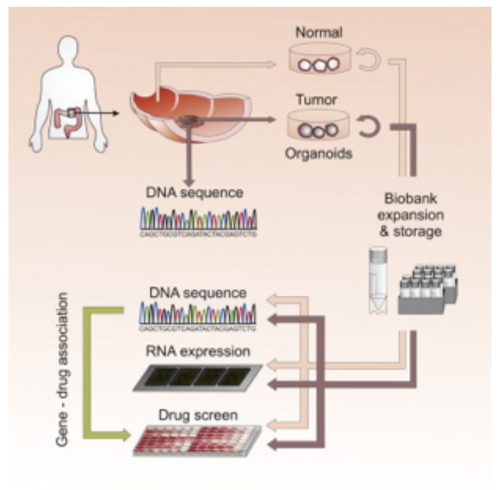
ill. 4 : strategia di medicina personalizzata grazie ad un modello di coltura in vitro di tumore del colon
Patologie del sistema respiratorio
Modello in vitro Mucilair™
Le patologie del sistema respiratorio, quali le allergie, l’asma o la broncopneumopatia cronica ostruttiva (BPCO) sono diventate, insieme agli inquinamenti ambientali, le principali sfide sanitarie. Grazie alle tecniche di ingegneria tissutale, è possibile ricostituire, a partire da scarti operatori, dei modelli in vitro di queste diverse patologie. Possiamo citare il modello in vitro di epitelio respiratorio umano Mucilair™ messo a punto dai ricercatori della ditta ginevrina Epithélix. Questi tessuti respiratori ricostituiti consentono la sostituzione dei test su animali in certi studi di tossicità (impatto degli agenti inquinanti ambientali, dei prodotti chimici, materiali inalati, ecc.) e lo sviluppo di nuovi farmaci.
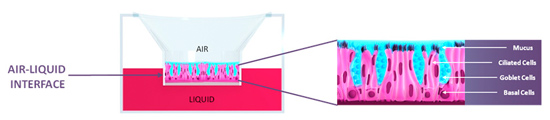
Modelli in vitro senza equivalente animali
La mucoviscidosi
Poichè certe malattie genetiche umane sono tuttora difficilmente modellizzabili nell’animale, i tessuti respiratori in vitro consentono di fare molti più progressi nella ricerca.
E’ il caso della mucoviscidosi in cui la disfunzione di un canale ionico del cloro (CFTR) genera un incremento della viscosità del muco ed il suo accumulo nelle vie respiratorie, ed a termine, molteplici infezioni farmacoresistenti. Sono stati creati diversi modelli murini ma nessuno riproduce le lesioni polmonari caratteristiche individuate nei pazienti umani. Il modello Mucilair™, ideato a partire da cellule mutate per il CFTR, consente di riprodurre il fenotipo respiratorio della mucoviscidosi e lo studio per la messa a punto ed il collaudo di nuovi farmaci.
Infezioni virali
Mucilair™ è utilizzato con efficacia anche nel campo delle infezioni virali. Certi ceppi virali presentano un tropismo di specie e sono capaci di infettare esclusivamente le mucose respiratorie umane. Senza modello di replicazione, non vi è dunque possibilità di studiare questi virus in laboratorio. Era il caso dei rhinovirus di tipo C responsabili del raffreddore nell’uomo. Recentemente si è potuto mostrare per la prima volta la replicazione in vitro dei ceppi HRVC2, 7, 12 15 e 29 con il modello Mucilair™, che consente peraltro la replicazione in vitro dei virus dell’influenza e dei bocavirus responsabili di epatiti.
Modello in vitro 3D : Maggiore sicurezza per i pazienti sotto trattamento medicamentoso
La tossicità epatica
La tossicità epatica è uno dei problemi più spinosi cui si scontra lo sviluppo di farmaci. In effetti è indispensabile ottenere il profilo tossicologico di una molecola (ADME) prima di utilizzarlo in prova clinica. I modelli animali o le culture cellulari classiche in 2D non rispecchiano la complessità di un organo 3D e pertanto i dati sperimentali ottenuti su questi modelli consentono di anticipare solo parzialmente la tossicità che potrà essere osservata in vivo, nell’uomo. Risulta da dati recenti che colture organotipiche 3D di cellule umane di fegato, le HepaRG, possono positivamente sostituire i modelli animali apportando informazioni molto più pertinenti e predittive.
Il futuro per la ricerca e la sanità pubblica
Come si evolveranno le nuove tecniche di ricerca senza animali? Tutto dipenderà dai fondi stanziati per questi metodi promettenti. Ma diverse tecniche interessanti sono già in fase avanzata di sviluppo e lasciano presagire progressi spettacolari per la ricerca e la pubblica sanità.
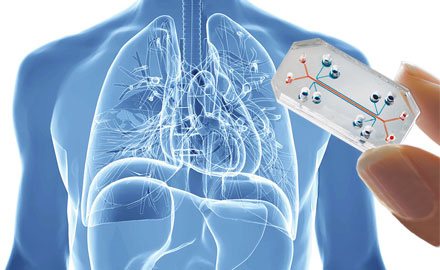
Il modello “Organ-on-chips”
Questo tipo di modello è in linea con i lavori del Prof. Donald Ingber dell’Istituto Wyss all’Università di Harvard (USA), che per primo ha realizzato una rete di microfluidica collegando tra loro diversi tipi cellulari collocati in microcamere d’incubazione. Questi micro- organi interconnessi consentono di simulare reazioni fisiologiche globali. Pertanto, l’assorbimento sistemico ed il metabolismo dei farmaci a livello di intestino tenue, il loro metabolismo attraverso il fegato come pure l’escrezione dal rene sono i principali determinanti di efficacia e di sicurezza per i candidati terapeutici. Tuttavia, queste risposte sistemiche all’applicazione di queste sostanze mancano nella maggior parte delle prove in vitro. Grazie alla microfluidica abbinata all’ingegneria tissutale, oggi è possibile simulare la fisiologia e preservare la funzionalità di questi micro-organi (pelle, intestino, fegato e rene) per un mese ! Questo sistema consente di ottenere in vitro i profili tossicologici (ADME) di candidati farmaci facendo a meno di esperimenti sugli animali. Ora l’obiettivo è di sviluppare « chip » ancora più complete, integrando la maggior parte degli organi umani.
La stampa 3D di interi organi
Il bioprinting 3D è una tecnica che consente di stampare in tre dimensioni, strati successivi di cellule su biomatrici per una riproduzione reale della struttura di un intero organo. Il Bioprinting è già stato utilizzato per produrre pelle, ossa, graft vascolari, stecche tracheali, tessuto cardiaco e strutture cartilaginee. Sebbene ancora molto recente, questo metodo è molto promettente, non solo nel campo della medicina rigenerativa, ma anche per lo sviluppo di farmaci e la ricerca in tossicologia.

L’immunologia, una sfida per lo sviluppo dei metodi sostitutivi
Stando all’ultimo rapporto della Commissione europea (7), oltre il 60% degli animali utilizzati per la sperimentazione, lo sono nel campo della medicina umana. I due principali assi di ricerca sono l’immunologia (15% degli animali) e la ricerca sul cancro (13%) (UK 2013 report, Home office).
Se un gran numero di innovazioni nel campo dei metodi di sostituzione riguarda la ricerca sul cancro, per il momento nessun modello sostitutivo consente di riprodurre in vitro in modo completo, la fisiologia del sistema immunitario. E la strada sembra ancora lunga prima di poter risolvere questo problema.
In un futuro abbastanza ravvicinato, sarà piuttosto grazie a simulazioni matematiche volte a stabilire in silico una serie di algoritmi, che sarà forse possibile simulare le reazioni immunitarie.
Molti gruppi di ricerca hanno già imboccato questa strada (8).
Basta con lo spreco di tessuti umani
Un gran numero di metodi sostitutivi per la ricerca fondamentale fanno capo direttamente all’utilizzazione di tessuti umani provenienti da scarti operatori o da biopsie. Queste risorse sono indispensabili e l’accesso a questi tessuti, al tempo stesso da parte dei laboratori accademici e dalle ditte di biotecnologia, deve essere esteso.
Questa messa a disposizione implica al tempo stesso una migliore valorizzazione dei tessuti umani, un’organizzazione più efficiente dei centri di raccolta, ed un allentamento del quadro legislativo eccessivamente restrittivo, nel rispetto dell’etica e della dignità umana.
Attualmente, la quasi totalità di questi tessuti deve essere incenerita a caro prezzo dagli ospedali allorchè numerosi gruppi di ricerca hanno difficoltà a trovare i tessuti necessari per i loro lavori.
Un’alternativa al « riciclaggio » di questi tessuti umani potrebbe venire dal miglioramento delle tecniche di riprogrammazione cellulare che consentono la differenziazione di cellule staminali in tutti i tipi cellulari, ed inversamente la de-differenziazione ed amplificazione di cellule differenziate in precursori cellulari, fornendo in tal modo una fonte inesauribile di cellule proprie ad ogni paziente.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Fonti:
1) I fondi dedicati dalle ditte farmaceutiche alla ricerca ed allo sviluppo di nuovi prodotti rappresentano tra il 10 ed il 20% del loro fatturato.
2) Arrowsmith 2012, 2013
3) Scannell 2012
4) Meno del 5%, Hutchinson 2011, Bhattacharjee 2012
5) Song, 2014, Straussman 2012, Lee 2014
6) Forsyth 2002, Odom 2007, Ramgarajan 2004, Mestas 2004, Seok 2013, Dorman 2010
7) Rapporto 859 della Commissione europea (2013)
8) A questo proposito, vedere i lavori di biologia computazionale del gruppo del Prof. Regoes (Garcia 2015).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Letteratura:
Amann A et al. Development of an innovative 3D cell culture system to study tumour–stroma interactions in non-small cell lung cancer cells. PLoS One. 2014 (doi:10.1371/journal.pone.0092511).
Bhattacharjee Y. Biomedicine. Pharma firms push for sharing of cancer trial data. Science. 2012 (doi: 10.1126/science.338.6103.29.)
Deng, X., Li, Y., & Qiu, J. Human bocavirus 1 infects commercially available primary human airway epithelium cultures productively. 2014 Journal of virological methods, 195, 112-119.
Fernández-Sánchez ME et al. Mechanical induction of the tumorigenic β-catenin pathway by tumour growth pressure. Nature. 2015 (doi: 10.1038/nature14329).
Garcia V, Richter K, Graw F, Oxenius A, Regoes RR: Estimating the in vivo killing efficacy of cytotoxic T lymphocytes across different peptide-MHC complex densities. PLoS Computational Biology 2015, 11(5):e1004178.
Ghosh S et al. Use of multicellular tumor spheroids to dissect endothelial cell-tumor cell interactions: a role for T-cadherin in tumor angiogenesis. FEBS Lett. 2007 581(23):4523-8.
Grubb BR, Boucher RC. Pathophysiology of gene-targeted mouse models for cystic fibrosis. Physiol Rev. 1999 79(1 Suppl):S193-214.
Hoffmann TK et al. A novel mechanism for anti-EGFR antibody action involves chemokine-mediated leukocyte infiltration. Int J Cancer. 2009 (doi: 10.1002/ijc.24269).
Hutchinson L . High drug attrition rates—where are we going wrong? Nature Reviews Clinical Oncology. 2011 (doi:10.1038/nrclinonc.2011.34).
Huh, D., et al., Reconstituting organ-level lung functions on a chip. Science, 2010. 328(5986):p. 1662-8.
Hirschhaeuser F, Leidig T, Rodday B, Lindemann C, Mueller-Klieser W. Test system for trifunctional antibodies in 3D MCTS culture. J Biomol Screen. 2009 (doi: 10.1177/1087057109341766).
Hirschhaeuser F, Menne H, Dittfeld C, West J, Mueller-Klieser W, Kunz-Schughart LA. Multicellular tumor spheroids: an underestimated tool is catching up again. J Biotechnol. 2010 (doi:10.1016/j.jbiotec.2010.01.012).
Juozapaitis et al. An infectious bat-derived chimeric influenza virus harbouring the entry machinery of an influenza A virus. 2014 Nature communications,5.
Konur A, Kreutz M, Knüchel R, Krause SW, Andreesen R. Cytokine repertoire during maturation of monocytes to macrophages within spheroids of malignant and non-malignant urothelial cell lines. Int J Cancer. 1998 78(5):648-53.
Labarbera DV, Reid BG, Yoo BH. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opin Drug Discov. 2012 (doi: 10.1517/17460441.2012.708334)
Lee JJ et al. Stromal response to Hedgehog signaling restrains pancreatic cancer progression. Proc Natl Acad Sci U S A. 2014 (doi: 10.1073/pnas.1411679111).
McMillin DW, Negri JM, Mitsiades CS. The role of tumour-stromal interactions in modifying drug response: challenges and opportunities. Nat Rev Drug Discov. 2013 (doi: 10.1038/nrd3870).
Mueller D, Krämer L, Hoffmann E, Klein S, Noor F. 3D Organotypic HepaRG cultures as in vitro model for acute and repeated dose toxicity studies. Toxicol In Vitro. 2014 (doi: 10.1016/j.tiv.2013.06.024)
Mas C, Boda B, CaulFuty M, Huang S, Wiszniewski L and Constant S. Antitumour efficacy of the selumetinib and trametinib MEK inhibitors in a combined human airway-tumour-stroma lung cancer model. 2015 J Biotechnol (doi:10.1016/j.jbiotec.2015.01.012)
Maschmeyer et al. A four-organ-chip for interconnected long-term co-culture of human intestine, liver, skin and kidney equivalents. 2015 Lab Chip, (DOI: 10.1039/C5LC00392J)
Murphy SV and Atala A. 3D bioprinting of tissues and organs. 2014 Nat Biotechnol. (doi: 10.1038/nbt.2958).
Ocana A, Pandiella A, Siu LL, Tannock IF. Preclinical development of molecular-targeted agents for cancer. Nat Rev Clin Oncol. 2010 (doi: 10.1038/nrclinonc.2010.194).
Rodríguez-Enríquez S, et al. Energy metabolism transition in multi-cellular human tumor spheroids. J Cell Physiol. 2008 (doi: 10.1002/jcp.21392).
Roth A, Singer T. The application of 3D cell models to support drug safety assessment: opportunities & challenges. 2014. Adv Drug Deliv Rev. (doi: 10.1016/j.addr.2013.12.005).
Saint-Criq et al. Restoration of chloride efflux by azithromycin in airway epithelial cells of cystic fibrosis patients. Antimicrob Agents Chemother. 2011 ( doi: 10.1128/AAC.01403-10).
Sequist et al. Implementing multiplexed genotyping of non-small-cell lung cancers into routine clinical practice. 2011 Ann. Oncol. 22, 2616–2624.
Straussman R et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 2012 (doi: 10.1038/nature11183).
Song G et al. Effects of tumor microenvironment heterogeneity on nanoparticle disposition and efficacy in breast cancer tumor models. Clin Cancer Res. 2014 (doi: 10.1158/1078-0432.CCR-14-0493)
Scannell JW, Blanckley A, Boldon H, Warrington B. Diagnosing the decline in pharmaceutical R&D efficiency. Nat Rev Drug Discov. 2012 (doi: 10.1038/nrd3681).
Tapparel, C., Sobo, K., Constant, S., Huang, S., Van Belle, S., & Kaiser, L. Growth and characterization of different human rhinovirus C types in three-dimensional human airway epithelia reconstituted in vitro. 2013 Virology, 446(1), 1-8.
Thoma CR. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Adv Drug Deliv Rev. 2014 (doi: 10.1016/j.addr.2014.03.001).
Van de Wetering et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015 (doi: 10.1016/j.cell.2015.03.053).
Vörsmann H et al. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death Dis. 2013 ( doi:10.1038/cddis.2013.249).
Walles et al., The potential of bioartificial tissues in oncology research and treatment. Onkologie, 2007. 30(7): p. 388-94.