Das Genfer Start-up FluoSphera hat eine revolutionäre Technologie entwickelt, mit der sich die Kommunikation zwischen menschlichen Organen nachbilden lässt. Interview mit Gregory Segala, Mitbegründer von FluoSphera.
 Warum haben Sie FluoSphera entwickelt?
Warum haben Sie FluoSphera entwickelt?
Als Zellbiologe beschäftigte ich mich mit therapeutischen Ansatzpunkten, sogenannten Targets. Die damals verfügbaren In-vitro-Modelle genügten meinen Ansprüchen nicht, weil sie den menschlichen Körper nie als System interagierender Organe abbildeten. Die Tiermodelle hingegen unterschieden sich zu stark vom menschlichen Organismus. Im Tiermodell können nur gerade 10 Prozent der bei Patient*innen und Patienten beobachteten Medikamentenwirkungen vorhergesagt werden. Das bedeutet umgekehrt, dass 90 Prozent der für den Menschen relevanten Wirkungen im Tiermodell unentdeckt bleiben. Tiere sind keine Miniatur-Menschen und Tiermodelle dürfen nicht als langfristige Lösung betrachtet werden. Sie sind eher eine Übergangslösung, bis Technologien wie FluoSphera aussagekräftigere Modelle für die menschliche Biologie bereitstellen. Selbst wenn Tiere eine ähnliche Anatomie wie der Mensch aufweisen, werden die physiologischen Prozesse bei ihnen anders reguliert. Dieser Faktor ist entscheidend für die unterschiedliche Wirkung von Arzneimitteln auf Tier und Mensch.
Ich hatte das Glück, Professor Aurélien Roux zu begegnen. Seine Zellverkapselungstechnologie brachte mich auf die Idee, damit die Multi-Gewebesysteme von FluoSphera zu entwickeln. Die Kommunikation zwischen den Organen kann metabolisch oder hormonell erfolgen. Sie ist entscheidend für das Funktionieren des menschlichen Organismus. Wenn es gelingt, diese Kommunikation in vitro nachzubilden, kann die Wirkung von neuen Arzneimitteln auf die Patient*innen und Patienten besser vorhergesagt werden. Diese sogenannte systemische Wirkung kann mit unserer Technologie gezielt gemessen werden. Das war bisher nur im Tiermodell möglich. Es war also höchste Zeit für eine neue In-vitro-Methode, die auf menschlichem Gewebe basiert und die Kommunikation zwischen den menschlichen Organen reproduzieren kann.
Was ist ein Organoid?
Ein Organoid ist eine Mini-Kopie eines Organs. Es bildet die räumliche Organisation, die Zellzusammensetzung und gewisse Funktionen eines Organs nach. Organoide werden aus Stammzellen entwickelt, indem man diese den Faktoren aussetzt, die für die Organentwicklung beim Embryo verantwortlich sind. Durch die Wahl der geeigneten Faktoren können Mini-Kopien des gewünschten Organs generiert werden: Herz-, Gehirn-, Darm- oder Nieren-Organoide. Ausgangspunkt für die Stammzellen sind somatische Zellen, die von freiwilligen Erwachsenen stammen und zu sogenannten induzierten pluripotenten Stammzellen umprogrammiert werden.
Mit welchen Zelltypen arbeiten Sie?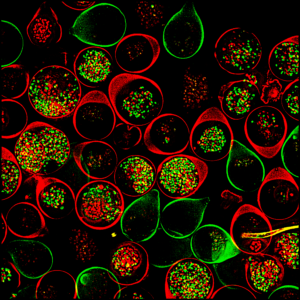
Die erwähnten somatischen Zellen sind reife, spezialisierte Körperzellen, die unseren Organen die jeweiligen Eigenschaften verleihen. Dazu gehören zum Beispiel Nerven-, Immun- und Gefässzellen. Stammzellen hingegen sind unreife Zellen. Sie sind die Urform aller somatischen Zellen und können sich zu fast jeder Art von Körperzelle entwickeln und so ganze Organe bilden.
Inwiefern ist diese Methode zuverlässiger?
Unsere Systeme nutzen ausschliesslich Gewebe menschlichen Ursprungs, damit Medikamentenwirkungen, die später bei den Patient*innen und Patienten auftreten, besser abgebildet werden können. Im Gegensatz zu klassischen In-vitro-Methoden, die aus isolierten Geweben bestehen und so die Vorgänge auf Ebene des Organismus nur ungenügend abbilden, reproduzieren unsere Multi-Gewebesysteme die Kommunikation zwischen verschiedenen menschlichen Organen.
Kann Ihre Technologie Tierversuche vollständig ersetzen?
Nach den aktuell geltenden Vorschriften dürfen Tierversuche, die für die Erprobung eines neuen Arzneimittels in der klinischen Phase erforderlich sind, nicht durch unsere Methode ersetzt werden. Wenn unsere Technologie einmal als Alternativmethode anerkannt ist, kann sie aber Optimierungstests an Tieren ersetzen. Bei diesen Tests geht es um die Reduktion der Toxizität und die Steigerung der Wirksamkeit von Molekülen.
 Warum setzt die Forschung weiterhin auf das unzuverlässige Tiermodell?
Warum setzt die Forschung weiterhin auf das unzuverlässige Tiermodell?
Die Wissenschaftsgemeinschaft im Life-Sciences-Bereich ist sehr konservativ und skeptisch gegenüber neuen Technologien. Das Tiermodell ist wenig zuverlässig, aber gut etabliert. Während Jahrzehnten brachten Tierversuche bessere Ergebnisse als In-vitro-Methoden, die lange Zeit über eine geringe biologische Aussagekraft verfügten. Neue Methoden wie FluoSphera sind aber deutlich aussagekräftiger. Damit die Akzeptanz von neuen Alternativmethoden steigt, müssen wir aufzeigen, dass diese Methoden dem Tiermodell überlegen sind.
Warum ist die Mittelbeschaffung für die Entwicklung von Alternativmethoden schwieriger?
Alternativmethoden müssen in zahlreichen Experimenten validiert werden, damit sie wissenschaftlich anerkannt werden. Das kostet viel Zeit und Geld. Gegenwärtig wird vor allem die Entwicklung von neuen Therapien finanziert. In die Entwicklung von neuen biologischen Methoden, zu denen auch die tierfreien Alternativmethoden zählen, fliesst kaum Geld. Der Übergang vom Tiermodell zu Ersatzmethoden lässt sich nur mit grösserer finanzieller Unterstützung beschleunigen, aber es gibt nur wenige spezifische Unterstützungsmassnahmen für Alternativmethoden. Ohne die nötigen Mittel verlaufen vielversprechende Projekte im Sand, noch bevor sie die Marktreife erreicht haben.
Ist Ihnen der ethische Aspekt wichtig?
Ethik ist ein wesentlicher und unverzichtbarer Teil der Forschung. Die Forschung kann potenziell alle Bereiche erkunden. Sie ist ein leistungsfähiges Instrument, das die Entwicklung unserer Gesellschaft mitbestimmt. Sie muss deshalb sorgsam kontrolliert werden. Die Ethik setzt Grenzen und einen moralischen Rahmen, in dem sich die Forschung bewegen muss, damit die moralischen Werte der Gesellschaft gewahrt bleiben.
Welche Projekte verfolgt FluoSphera aktuell?
Wir entwickeln ein In-vitro-System, welches das weibliche endokrine System modelliert und die Entwicklung von wirksameren, zuverlässigeren und weniger toxischen Hormontherapien ermöglicht. Das Modell kann endokrine Disruptoren identifizieren und dadurch sicherstellen, dass die Bevölkerung diesen gesundheitsschädigenden Substanzen, welche die Hormonaktivität beeinflussen, nicht ausgesetzt wird. Ausserdem entwickeln wir ein Leber-Herz-System mit einem in vitro schlagenden Herz-Organoid. Mit diesem Modell können Leber- und Herztoxizitäten detektiert werden. Diese machen rund 40 Prozent der toxischen Wirkungen von Medikamenten aus und sind für den Grossteil der Misserfolge in der klinischen Phase I verantwortlich. Das Modell ermöglicht die Entwicklung von wirksameren Therapien für kardiovaskuläre Erkrankungen und die frühzeitige Entdeckung von Toxizitäten, noch bevor die Medikamente klinisch getestet werden. Damit bietet es eine dringend erforderliche Alternative zur Untersuchung der Herztoxizität, die das Tiermodell nicht vorhersagen kann. FluoSphera sucht nach Finanzierungsmöglichkeiten für die Weiterentwicklung ihrer Technologie.
– – – –
Kurzbiografie
2012: Doktorat in Onkologie – Toulouse
2012: Studie zur Funktion von Östrogenrezeptoren, therapeutische Targets bei Brustkrebs – Genf
2019: Das Erfinderteam von FluoSphera gewinnt die Silbermedaille beim internationalen Wettbewerb für synthetische Biologie iGEM in Boston
2020: Segala verlässt die akademische Forschung, um sich ganz dem Transfer der neuen Technologie in die Industrie zu widmen. Das Ziel ist, die Methode für die Entdeckung neuer Wirkstoffe einzusetzen und so die Zahl der Tierversuche zu reduzieren.
– – – –
Videoreportage bei FluoSphera auf unserer Youtube-Seite



