Les méthodes substitutives pour la recherche médicale et toxicologique
Les stratégies de recherche de l’industrie pharmaceutique remises en question
Chaque année, les industries pharmaceutiques investissent des milliards d’euros 1) et utilisent des millions d’animaux dans le but de mettre au point de nouveaux médicaments. Pourtant, près de 70% des molécules testées en essai clinique seront disqualifiées, soit par manque d’efficacité, soit pour cause de toxicité 2). Aujourd’hui de nombreuses analyses publiées dans d’importantes revues scientifiques comme Nature ou Science, citent le manque de pertinence des modèles animaux comme possible raison de cet échec, et suggèrent de modifier les stratégies de recherche en utilisant davantage de modèles substitutifs basés sur des cellules humaines, afin d’être plus représentatifs de la biologie humaine et donc plus prédictifs 3).

Recherche sur le cancer : Nous avons besoin de meilleurs modèles d’études !
Ce constat est particulièrement marqué dans le domaine de l’oncologie, où les rares molécules finalement validées par les autorités du médicament 4), ne parviennent pour la plupart qu’à prolonger la vie du patient de quelques mois, sans éradiquer la maladie.
La tumeur : une structure complexe
On sait aujourd’hui qu’une tumeur est une structure hétérogène qui résulte de l’interaction permanente entre différents types de cellules cancéreuses et leur environnement immédiat. Ainsi, la formation et la croissance d’une tumeur répondent à la fois à des contraintes mécaniques provenant des tissus normaux adjacents et à des signaux moléculaires provenant des cellules saines composants ces tissus. Les cellules tumorales ont par exemple la capacité de détourner les propriétés de cellules présentes dans la matrice les entourant, telles que les fibroblastes ou les cellules endothéliales, afin de favoriser leur propre croissance. Plusieurs études ont montré que la capacité d’un médicament à atteindre la tumeur, ainsi que son efficacité à éliminer les cellules cancéreuses, dépendent de la nature même du microenvironnement de cette tumeur 5). Pour ces raisons, il est impératif d’intégrer la tumeur et son microenvironnement dans les modèles permettant la mise au point de nouvelles thérapies.
Des modèles animaux imparfaits

La majorité des modèles précliniques sont des modèles animaux, bien qu’ils ne soient pas assez représentatifs de la physiologie des tumeurs humaines. Ainsi, dans le modèle animal couramment utilisé de la « xénogreffe » où des cellules ou fragments de tumeurs humaines sont implantées sous la peau de la souris, l’environnement humain original de la tumeur est perdu, entraînant un défaut de régulation et une croissance trop rapide de la tumeur qui ne correspond pas à la situation observée in vivo chez le patient. Du fait de leur croissance élevée et d’un environnement inadéquat, ces tumeurs artificielles deviennent très sensibles aux anticancers et conduisent à sélectionner des molécules qui seront inefficaces lors des tests cliniques chez l’homme. De nombreuses publications ont confirmé l’existence de différences fondamentales entre la souris et l’homme dans les mécanismes moléculaires impliqués dans la biologie des tumeurs tels que la régulation de la transcription, l’activité des télomérases, les mécanismes de transformation, la production de cytokines ou la composition de la matrice extracellulaire 6). Malgré tout, les modèles murins continuent à être utilisés par millions pour la recherche contre le cancer, et chaque résultat positif est annoncé comme porteur d’espoir pour le développement de nouvelles thérapies.
Des modèles in vitro de plus en plus prédictifs
Les récents progrès en culture cellulaire et en ingénierie tissulaire humaine permettent aujourd’hui de développer in vitro des modèles de cancer substitutifs qui reproduisent de plus en plus fidèlement la maladie telle qu’elle se développe chez les patients. Parmi les modèles déjà utilisés pour la recherche, on peut notamment citer :
Le modèle des «multicellular tumor spheroids» (MCTS)
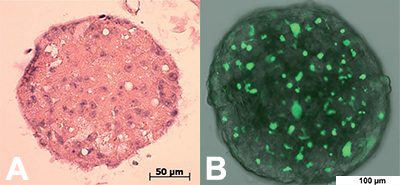
Dans ce modèle, des cellules cancéreuses sont cultivées in vitro en 3D afin d’augmenter les interactions entre les cellules, sous forme de petits organoïdes sphériques (Figure 1). Lorsque les sphéroïdes atteignent une certaine taille ils présentent une zone externe en prolifération, une zone intermédiaire quiescente et un noyau central nécrotique, une organisation qui permet de reproduire les gradients de nutriments et d’oxygénation tels qu’ils existent dans la tumeur humaine originale. De plus, ces sphéroïdes peuvent être cultivés en présence de cellules de la matrice extracellulaire, de la microvasculature ou même du système immunitaire qui vont contribuer à simuler le microenvironnement de la tumeur.
Depuis qu’il est possible d’automatiser la fabrication des sphéroïdes, ce modèle est très utilisé par l’industrie pharmaceutique. Il permet de tester un grand nombre de molécules (High Throughput Screening) sur des micro-cancers du colon, de la prostate, du foie, du rein et des voies aérodigestives supérieures et de sélectionner rapidement les candidats médicaments les plus prometteurs qui seront ensuite testés sur des modèles plus complexes. Ce modèle a par exemple été utilisé pour la mise au point du Catumaxomab, un anticorps aujourd’hui validé par l’EMA (Agence Européenne du Médicament) pour le traitement d’ascites malignes.
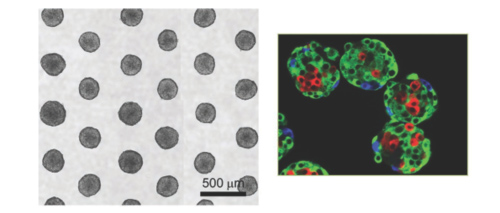
Fig 1 : exemple de microsphères (gauche) et marquage des différents types cellulaires (droite), Labarbera 2012
Le modèle des « tissus cancéreux reconstitués »
Il est possible grâce aux méthodes d’ingénierie tissulaire et de bio-printing, de sélectionner et de réorganiser de multiples types cellulaires afin de reconstruire in vitro un fragment de tissu humain. En incorporant dans ces tissus des cellules tumorales, il devient possible de reconstituer le processus de croissance de micro-tumeurs dans un environnement fonctionnel et donc de simuler la maladie telle qu’elle se développe chez le patient. Ces modèles complexes existent pour le cancer du mélanome et le cancer du poumon (OncoCilAir™). Ils présentent un grand intérêt puisqu’ils permettent de tester non seulement l’efficacité du futur médicament sur la partie tumorale, mais aussi sa possible toxicité sur les cellules saines de la culture.
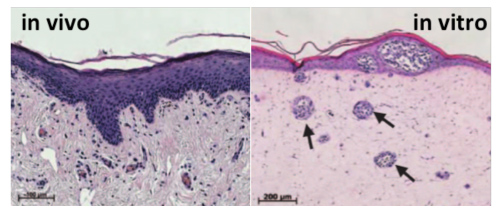
Fig 2 : coupe de peau humaine native (à gauche) et reconstituée in vitro avec des mélanomes (à droite, flèches)
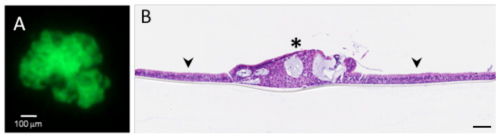
Fig 3 : (A) Nodule tumoral et (B) coupe de tissu pulmonaire (flèche) avec tumeur (étoile) reconstitué in vitro
Le modèle OncoCilAir™ a l’avantage de rester fonctionnel pendant plusieurs mois, ce qui permet de tester à la fois des traitements aigus et chroniques et donc de simuler les dosages qui seront prescrits aux patients pendant les essais cliniques.
Des modèles in vitro pour la médecine personnalisée
Il est maintenant établi qu’un même type de cancer peut résulter de mutations différentes, ce qui explique que tous les patients atteints par exemple d’un cancer du colon ne sont pas forcément sensibles au même traitement. L’idéal serait de pouvoir tester l’efficacité de tous les traitements disponibles sur chaque tumeur afin d’identifier une thérapie adaptée sur mesure à chaque patient: c’est la médecine personnalisée. Cette stratégie, déjà au point pour le cancer du colon, va sans doute être rapidement utilisée en clinique. Elle permet également d’étudier l’expression de biomarqueurs directement sur du matériel humain provenant du patient à différents temps du traitement, de façon à prédire l’évolution de la maladie.
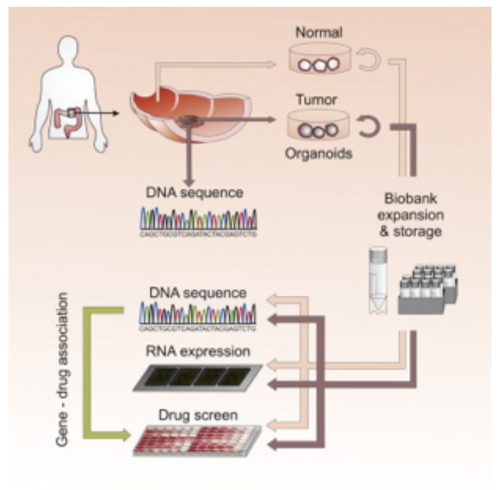
Fig 4 : Stratégie de médecine personnalisée grâce à un modèle de culture in vitro de tumeur du colon
Pathologies du système respiratoire
Modèle in vitro Mucilair™
Les pathologies du système respiratoire, telles que les allergies, l’asthme ou la broncho-pneumopathie chronique obstructive (BPCO) sont devenues, avec l’augmentation des pollutions environnementales, des enjeux de santé majeurs. Grâce aux techniques d’ingénierie tissulaire, il est possible de reconstituer, à partir de déchets opératoires, des modèles in vitro de ces différentes pathologies. On peut citer le modèle in vitro d’épithélium respiratoire humain Mucilair™ développé par les chercheurs de la société genevoise Epithélix. Ces tissus respiratoires reconstitués permettent le remplacement des tests sur animaux dans des études de toxicité (impact des polluants environnementaux, des produits chimiques, matériaux inhalés, etc.) et la mise au point de nouveaux médicaments.
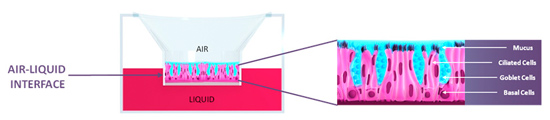
Des modèles in vitro sans équivalents animaux
La mucoviscidose
Certaines maladies génétiques humaines restant difficilement modélisables chez l’animal, les tissus respiratoires in vitro permettent d’aller beaucoup plus loin dans la recherche.
C’est le cas de la mucoviscidose où le disfonctionnement d’un canal ionique transporteur du chlore (CFTR) entraîne une augmentation de la viscosité du mucus et son accumulation dans les voies respiratoires, et à terme de multiples infections pharmaco-résistantes. De nombreux modèles murins ont été créés, mais aucun ne reproduisait les lésions pulmonaires caractéristiques retrouvées chez les patients humains. Le modèle Mucilair™, établi à partir de cellules mutées pour le CFTR, permet de reproduire le phénotype respiratoire de la mucoviscidose et l’étude pour la mise au point et le test de nouveaux médicaments.
Infections virales
Mucilair™ est aussi utilisé avec efficacité dans le domaine des infections virales. Certaines souches virales présentent un tropisme d’espèce et sont capables d’infecter uniquement les muqueuses respiratoires humaines. Sans modèle de réplication, il n’y a donc pas de possibilité d’étudier ces virus en laboratoire. C’était le cas des rhinovirus de type C responsables du rhume chez l’homme. Récemment, il a été possible de montrer pour la première fois la réplication in vitro des souches HRVC2, 7, 12 15 et 29 avec le modèle Mucilair™, qui permet également la réplication in vitro de virus de la grippe et des bocavirus responsables d’hépatites.
Modèle in vitro 3D : Plus de sécurité pour les patients sous traitement médicamenteux
La toxicité hépatique
La toxicité hépatique est l’un des problèmes majeurs lors de la mise au point de médicaments. Il est en effet impératif d’obtenir le profil toxicologique d’une molécule (ADME) avant de l’utiliser en essai clinique. Les modèles animaux ou les cultures cellulaires classiques en 2D ne reflètent pas la complexité d’un organe 3D et par conséquent, les données expérimentales obtenues sur ces modèles ne permettent d’anticiper que partiellement la toxicité qui pourra être observée in vivo, chez l’homme. Des données récentes ont montré que des cultures organotypiques 3D de cellules humaines de foie, les HepaRG, peuvent remplacer avantageusement les modèles animaux en apportant des informations beaucoup plus pertinentes et prédictives.
Le futur pour la recherche et la santé publique
Comment évolueront les nouvelles techniques de recherche sans animaux ? Tout dépendra des fonds qui seront alloués à ces méthodes prometteuses. Mais plusieurs techniques intéressantes sont déjà en phase de développement avancée et promettent des progrès spectaculaires pour la recherche et la santé publique.
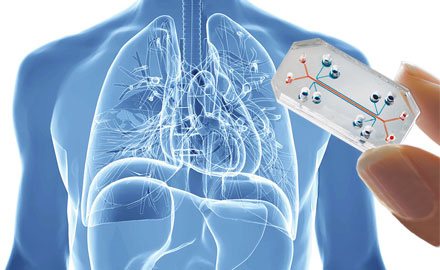
Le modèle “Organ-on-chips”
Ce type de modèle s’inscrit dans la continuité du travail du Prof. Donald Ingber de l’Institut Wyss à l’Université de Harvard (USA), qui a été le premier à réaliser un réseau de microfluidique en interconnectant plusieurs types cellulaires placés dans des micro-chambres d’incubation. Ces micro-organes interconnectés permettent de simuler des réactions physiologiques globales. Ainsi, l’absorption systémique et le métabolisme des médicaments au niveau de l’intestin grêle, leur métabolisme par le foie ainsi que l’excrétion par le rein sont les principaux déterminants de l’efficacité et de sécurité pour les candidats thérapeutiques. Cependant, ces réponses systémiques à l’application de ces substances manquent dans la plupart des essais in vitro. Grâce à la microfluidique combinée à l’ingénierie tissulaire, on peut aujourd’hui simuler la physiologie et maintenir la fonctionnalité de ces micro-organes (peau, intestin, foie et rein) durant un mois ! Ce système permet d’obtenir in vitro les profils toxicologiques (ADME) de candidats médicaments en s’affranchissant de tests animaux. L’objectif est maintenant de développer des « puces » encore plus complètes, intégrant la plupart des organes humains.
L’impression 3D d’organes entiers
Le bioprinting 3D est une technique permettant d’imprimer en trois dimensions des couches successives de cellules sur des bio-matrices afin de reconstituer à l’identique la structure d’un organe entier. Le Bioprinting a déjà été utilisé pour produire de la peau, des os, des greffons vasculaires, des attelles trachéales, du tissu cardiaque et des structures cartilagineuses. Bien qu’encore très récente, cette méthode est très prometteuse, non seulement pour le domaine de la médecine régénérative, mais aussi pour la découverte de médicaments et la recherche en toxicologie.

L’immunologie, un challenge pour le développement des méthodes substitutives
Selon le dernier rapport de la Commission Européenne 7), plus de 60% des animaux expérimentés sont utilisés dans le domaine de la médecine humaine, les deux axes principaux de recherche étant l’immunologie (15% des animaux) et la recherche sur le cancer (13%) (UK 2013 report, Home office).
Si un grand nombre d’innovations dans le domaine des méthodes de remplacement concerne la recherche sur le cancer, aucun modèle substitutif ne permet encore de reproduire in vitro de façon complète la physiologie du système immunitaire. Et le chemin semble encore long avant de pouvoir solutionner ce problème.
Dans un proche avenir, ce sont plutôt des simulations mathématiques visant à établir in silico des algorithmes qui permettront probablement de simuler les réactions immunitaires. Plusieurs groupes de recherche se sont déjà engagés dans cette voie 8).
Halte au gaspillage des tissus humains
Un grand nombre de méthodes substitutives pour la recherche fondamentale repose directement sur l’utilisation de tissus humains provenant de déchets opératoires ou de biopsies. Ces ressources sont indispensables et l’accès à ces tissus, à la fois par des laboratoires académiques ou par des compagnies de biotechnologie, doit être étendu.
Cette mise à disposition implique à la fois une meilleure valorisation des tissus humains, une organisation plus performante des centres de collecte, mais aussi un assouplissement du cadre législatif excessivement restrictif, tout en respectant l’éthique et la dignité humaine.
Actuellement, la quasi totalité de ces tissus doit être incinérée à grands frais par les hôpitaux alors que de nombreux groupes de recherche peinent à trouver les tissus nécessaires à leurs travaux.
Une alternative au « recyclage » de ces tissus humains pourrait venir de l’amélioration des techniques de reprogrammation cellulaire qui permettent la différentiation de cellules souches en tout type cellulaires, et inversement la dé-différentiation et l’amplification de cellules différenciées en précurseurs cellulaires, fournissant ainsi une source inépuisable de cellules propres à chaque patient.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Sources :
1) Les fonds engagés par les pharma pour la recherche et développement de nouveaux produits représentent entre 10 et 20% de leurs chiffres d’affaire.
2) Arrowsmith 2012, 2013
3) Scannell 2012
4) Moins de 5%, Hutchinson 2011, Bhattacharjee 2012
5) Song, 2014, Straussman 2012, Lee 2014
6) Forsyth 2002, Odom 2007, Ramgarajan 2004, Mestas 2004, Seok 2013, Dorman 2010
7) EU Com (2013) 859 report
8) Voir à ce sujet les travaux de biologie computationnelle du groupe du Prof. Regoes (Garcia 2015).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Littérature :
Amann A et al. Development of an innovative 3D cell culture system to study tumour–stroma interactions in non-small cell lung cancer cells. PLoS One. 2014 (doi:10.1371/journal.pone.0092511).
Bhattacharjee Y. Biomedicine. Pharma firms push for sharing of cancer trial data. Science. 2012 (doi: 10.1126/science.338.6103.29.)
Deng, X., Li, Y., & Qiu, J. Human bocavirus 1 infects commercially available primary human airway epithelium cultures productively. 2014 Journal of virological methods, 195, 112-119.
Fernández-Sánchez ME et al. Mechanical induction of the tumorigenic β-catenin pathway by tumour growth pressure. Nature. 2015 (doi: 10.1038/nature14329).
Garcia V, Richter K, Graw F, Oxenius A, Regoes RR: Estimating the in vivo killing efficacy of cytotoxic T lymphocytes across different peptide-MHC complex densities. PLoS Computational Biology 2015, 11(5):e1004178.
Ghosh S et al. Use of multicellular tumor spheroids to dissect endothelial cell-tumor cell interactions: a role for T-cadherin in tumor angiogenesis. FEBS Lett. 2007 581(23):4523-8.
Grubb BR, Boucher RC. Pathophysiology of gene-targeted mouse models for cystic fibrosis. Physiol Rev. 1999 79(1 Suppl):S193-214.
Hoffmann TK et al. A novel mechanism for anti-EGFR antibody action involves chemokine-mediated leukocyte infiltration. Int J Cancer. 2009 (doi: 10.1002/ijc.24269).
Hutchinson L . High drug attrition rates—where are we going wrong? Nature Reviews Clinical Oncology. 2011 (doi:10.1038/nrclinonc.2011.34).
Huh, D., et al., Reconstituting organ-level lung functions on a chip. Science, 2010. 328(5986):p. 1662-8.
Hirschhaeuser F, Leidig T, Rodday B, Lindemann C, Mueller-Klieser W. Test system for trifunctional antibodies in 3D MCTS culture. J Biomol Screen. 2009 (doi: 10.1177/1087057109341766).
Hirschhaeuser F, Menne H, Dittfeld C, West J, Mueller-Klieser W, Kunz-Schughart LA. Multicellular tumor spheroids: an underestimated tool is catching up again. J Biotechnol. 2010 (doi:10.1016/j.jbiotec.2010.01.012).
Juozapaitis et al. An infectious bat-derived chimeric influenza virus harbouring the entry machinery of an influenza A virus. 2014 Nature communications,5.
Konur A, Kreutz M, Knüchel R, Krause SW, Andreesen R. Cytokine repertoire during maturation of monocytes to macrophages within spheroids of malignant and non-malignant urothelial cell lines. Int J Cancer. 1998 78(5):648-53.
Labarbera DV, Reid BG, Yoo BH. The multicellular tumor spheroid model for high-throughput cancer drug discovery. Expert Opin Drug Discov. 2012 (doi: 10.1517/17460441.2012.708334)
Lee JJ et al. Stromal response to Hedgehog signaling restrains pancreatic cancer progression. Proc Natl Acad Sci U S A. 2014 (doi: 10.1073/pnas.1411679111).
McMillin DW, Negri JM, Mitsiades CS. The role of tumour-stromal interactions in modifying drug response: challenges and opportunities. Nat Rev Drug Discov. 2013 (doi: 10.1038/nrd3870).
Mueller D, Krämer L, Hoffmann E, Klein S, Noor F. 3D Organotypic HepaRG cultures as in vitro model for acute and repeated dose toxicity studies. Toxicol In Vitro. 2014 (doi: 10.1016/j.tiv.2013.06.024)
Mas C, Boda B, CaulFuty M, Huang S, Wiszniewski L and Constant S. Antitumour efficacy of the selumetinib and trametinib MEK inhibitors in a combined human airway-tumour-stroma lung cancer model. 2015 J Biotechnol (doi:10.1016/j.jbiotec.2015.01.012)
Maschmeyer et al. A four-organ-chip for interconnected long-term co-culture of human intestine, liver, skin and kidney equivalents. 2015 Lab Chip, (DOI: 10.1039/C5LC00392J)
Murphy SV and Atala A. 3D bioprinting of tissues and organs. 2014 Nat Biotechnol. (doi: 10.1038/nbt.2958).
Ocana A, Pandiella A, Siu LL, Tannock IF. Preclinical development of molecular-targeted agents for cancer. Nat Rev Clin Oncol. 2010 (doi: 10.1038/nrclinonc.2010.194).
Rodríguez-Enríquez S, et al. Energy metabolism transition in multi-cellular human tumor spheroids. J Cell Physiol. 2008 (doi: 10.1002/jcp.21392).
Roth A, Singer T. The application of 3D cell models to support drug safety assessment: opportunities & challenges. 2014. Adv Drug Deliv Rev. (doi: 10.1016/j.addr.2013.12.005).
Saint-Criq et al. Restoration of chloride efflux by azithromycin in airway epithelial cells of cystic fibrosis patients. Antimicrob Agents Chemother. 2011 ( doi: 10.1128/AAC.01403-10).
Sequist et al. Implementing multiplexed genotyping of non-small-cell lung cancers into routine clinical practice. 2011 Ann. Oncol. 22, 2616–2624.
Straussman R et al. Tumour micro-environment elicits innate resistance to RAF inhibitors through HGF secretion. Nature. 2012 (doi: 10.1038/nature11183).
Song G et al. Effects of tumor microenvironment heterogeneity on nanoparticle disposition and efficacy in breast cancer tumor models. Clin Cancer Res. 2014 (doi: 10.1158/1078-0432.CCR-14-0493)
Scannell JW, Blanckley A, Boldon H, Warrington B. Diagnosing the decline in pharmaceutical R&D efficiency. Nat Rev Drug Discov. 2012 (doi: 10.1038/nrd3681).
Tapparel, C., Sobo, K., Constant, S., Huang, S., Van Belle, S., & Kaiser, L. Growth and characterization of different human rhinovirus C types in three-dimensional human airway epithelia reconstituted in vitro. 2013 Virology, 446(1), 1-8.
Thoma CR. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Adv Drug Deliv Rev. 2014 (doi: 10.1016/j.addr.2014.03.001).
Van de Wetering et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015 (doi: 10.1016/j.cell.2015.03.053).
Vörsmann H et al. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death Dis. 2013 ( doi:10.1038/cddis.2013.249).
Walles et al., The potential of bioartificial tissues in oncology research and treatment. Onkologie, 2007. 30(7): p. 388-94.


